肝線維化におけるコラーゲン分泌と分泌経路の再構築
肝線維化は、慢性的な肝障害に対する過剰な創傷治癒反応として進行し、最終的には肝硬変に至る重篤な疾患です。従来、肝星細胞(HSC)が炎症性サイトカインの刺激を受けて線維芽細胞様細胞に分化し、コラーゲンなどの細胞外マトリックスを過剰に分泌することが、線維化の中心的な機構とされてきました。
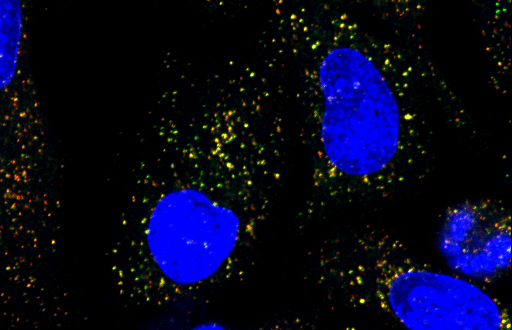
我々の研究では、肝星細胞の活性化に伴い、タンパク質分泌を担う小胞体やゴルジ体が顕著に拡大することに着目しました。この細胞内の分泌経路の再構築が、コラーゲンの過剰な分泌にどのように寄与しているのかを解析しています。
特に、分泌小胞を形成するCOPII被覆タンパク質の一部であるSec23AおよびSec24Dが、分化時に特異的に発現誘導されることを見出しました。この誘導には、膜貫通型転写因子CREB3L2(別名BBF2H7)が関与しており、これらの因子の発現を抑制すると肝星細胞の活性化自体が阻害されることも示しました。これらの成果から、Sec23A/Sec24Dを介した分泌経路の変化が肝線維化の進行に不可欠であることが示唆され、新たな治療標的として期待されます (Sci Rep, 2017)。
今後は、肝線維化におけるコラーゲン分泌の制御機構をより詳細に解明し、これを標的とした新しい治療法の開発を目指します。
Rewiring the Secretory Pathway in Liver Fibrosis
Liver fibrosis is a progressive pathological condition caused by an exaggerated wound-healing response to chronic liver injury, which can eventually lead to cirrhosis. A key step in fibrosis is the differentiation of hepatic stellate cells (HSCs) into myofibroblast-like cells under the influence of inflammatory cytokines. These activated HSCs secrete large amounts of extracellular matrix proteins such as collagen.
Our research focuses on how protein secretion is enhanced during HSC activation. We found that this activation is accompanied by striking expansion of the endoplasmic reticulum (ER) and Golgi apparatus, indicating extensive remodeling of the secretory pathway.
In particular, we discovered that two isoform-specific COPII inner coat proteins—Sec23A and Sec24D—are selectively upregulated during HSC activation, and this regulation is mediated by the ER-localized transmembrane bZIP transcription factor CREB3L2 (also known as BBF2H7). Importantly, knockdown of these components not only impaired ER-to-Golgi trafficking but also prevented HSC activation itself, highlighting the essential role of these secretory regulators in fibrosis progression (Sci Rep, 2017).
Through this research, we aim to uncover the molecular mechanisms governing collagen secretion in liver fibrosis and develop innovative anti-fibrotic therapies that target the secretory machinery.

