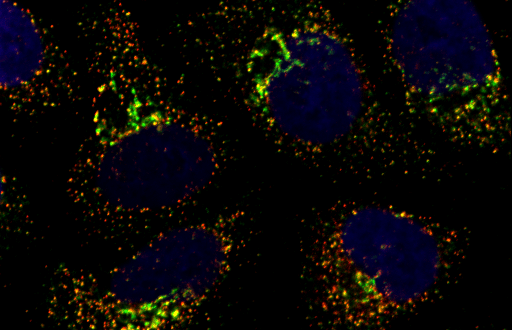
小胞体出芽部位 (ER exit site)形成機構の解明
哺乳細胞の小胞体出芽ドメイン(ER exit site)は、1つの細胞あたり数百個存在しますが、細胞周期や栄養状態などによって、その数や大きさ、局在が変化することが知られています。しかし、その分子機構はあまり明らかになっていません。われわれは、TANGO1にコラーゲン認識部位をもたないTANGO1Sが存在することを新たに見出し、TANGO1LとTANGO1SがSec16と結合することでER exit siteの形成を担っていることを明らかにしました(JCB 2017)。さらにTANGO1が細胞分裂期にリン酸化されることで、TANGO1とSec16の結合が減弱し、その結果ER exit siteの崩壊をおこすことを見出しました (Dev Cell 2020)。この知見は、ER exit siteからの分泌が停止する一つの理由であると考えられます。我々は今後も、ER exit site形成の分子メカニズムを明らかにしたいと考えています。この研究は、ER exit siteが関係する病気(がんなど)の治療法の開発などに役立つことが期待されます。
Mechanisms of ER exit site organization
In mammalian cells, several hundred ER exit sites (ERES) exist per cell, and their number, size, and subcellular localization are known to change depending on the cell cycle and nutrient status. However, the underlying molecular mechanisms remain poorly understood. We identified a previously unrecognized short isoform of TANGO1, termed TANGO1S, which lacks the collagen recognition domain. We demonstrated that both TANGO1L and TANGO1S contribute to ERES formation through their interaction with Sec16 (JCB, 2017). Furthermore, we found that TANGO1 is phosphorylated during mitosis, which weakens its interaction with Sec16, leading to the disassembly of ER exit sites (Dev Cell, 2020). This finding provides a possible explanation for the inhibition of secretion during cell division. We aim to continue elucidating the molecular mechanisms underlying the formation and regulation of ER exit sites.

